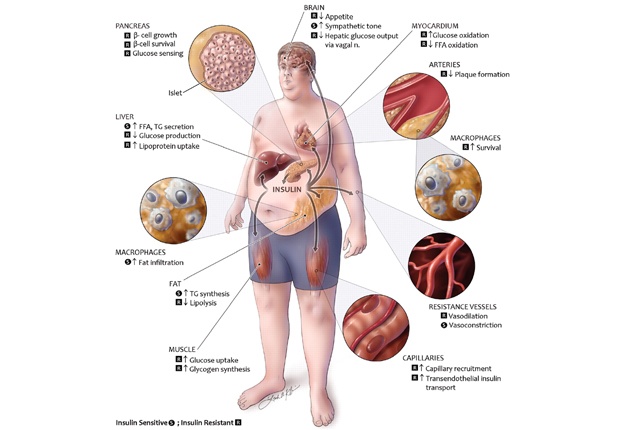
بیماری های نوروژنتیک
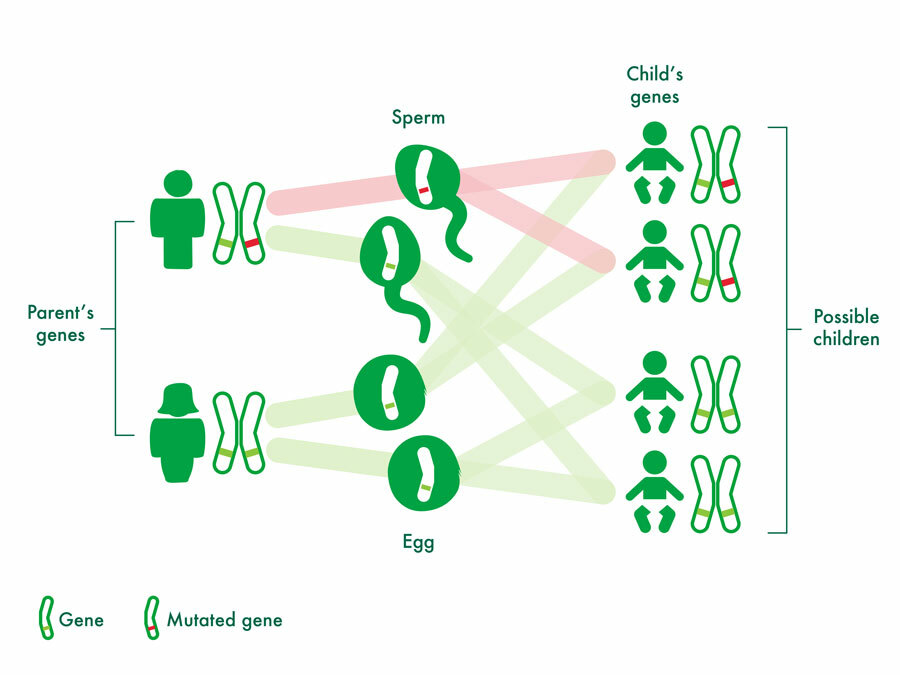
بیماری های نوروژنتیک ، اختلالاتی هستند که در
اثر تغییرات در ژن ها و کروموزوم ها به وجود می آیند. این بیماری ها ، مغز ، طناب
نخاعی، اعصاب و عضلات را تحت تاثیر قرار میدهند. علائم بیماری های نوروژنتیک میتوانند
در زمان تولد یا در مراحل بعدی زندگی ظاهر شوند. انواع بسیار زیادی اختلال
نوروژنتیک وجود دارند. با اینکه این بیماری ها از تغییرات ژنتیکی نشات میگیرند
اما تمام آن ها ارثی نیستند. انواع اختلالات نوروژنتیک شامل موارد زیر میباشند :
- اختلالات طیفی اوتیسم
- بدریختی های مغز
- تاخیر رشدی
- ناتوانی ذهنی و شناختی
- صرع ها و تشنج ها ( انواع ژنتیکی)
- اختلالات عصبی-عضلانی یا نوروماسکولار
- اختلالات عصبی-پوستی ( برای مثال نوروفیبروماتوز)
- سکته مغزی
- اختلالات نابود کننده اعصاب بویژه سلول های مغز
علائم بیماری های نوروژنتیک به میزان گسترده ای متنوع است و درحالیکه برخی علائم با گذر زمان تشدید میشوند ، علائم دیگر با افزایش سن کودکان بهبود مییابند. علائم بیماری های نوروژنتیک ممکن است بسیار شبیه به علائمی باشند که در اثر مشکلات نورولوژیکی غیرژنتیکی به وجود میآیند. اختلالات نوروژنتیک اکتسابی نیستند و دارای یک علت ژنتیکی میباشند. زمانیکه یک علت ژنتیکی شناسایی شود، اطلاعات ممکن است به خانواده ها برای فهم بهتر بیماری مربوطه کمک کند. عوامل ژنتیکی همچنین ممکن است امکان تخمین خطر بازگشت بیماری به خانواده را فراهم کرده و درمان را تحت تاثیر قرار دهند.
اختلالات عصب-عضله ( Neuromuscular disease)
ناهنجاری های عصبی عضلانی
شامل آسیب شناسی عضلانی، اتصالات عصبی عضلانی، عصب ها و نورونها در نخاع، ساقه
مغز و مغز می باشد که یک طبقه بندی خیلی متنوع از ناهنجاری های عصبی را ایجاد میکند.
که به سن بسیار وابسته است. NMD منشا ژنتیکی دارد و روی جهش های ژنی پایه ریزی شده است. اکثر
ناهنجاری های عصبی توسط جهش های ژنی ایجاد می شود که منجر به NMD می گردد.
مغز حرکات عضلات اسکلتی ( ارادی ) را از طریق اعصاب تخصصی کنترل میکند. همکاری سیستم عصبی و عضلات برای ایجاد حرکت به عنوان سیستم عصبی-عضلانی شناخته میشود.اگر شما بخواهید بخشی از بدن خود را حرکت دهید ، پیامی به نورون های ویژه ای ( سلول های عصبی ) که نورون های حرکتی بالایی نام دارند ارسال میشود. نورون های حرکتی بالایی دارای رشته های طویلی ( آکسون ها ) هستند که وارد مغز و طناب نخاعی میشوند. این نورون ها در طناب نخاعی با نورون های حرکتی پایینی ارتباط برقرار میکنند. نورون های حرکتی پایینی طناب نخاعی ، آکسون های خود را از طریق اعصاب دست ها و پاها به طور مستقیم به عضلاتی که کنترل میکنند میفرستند.
هر عضله طبیعی توسط 50 تا
200 ( یا بیشتر ) نورون حرکتی پایینی پشتیبانی میشود. هر نورون حرکتی پایینی به
رشته های نازک متعددی تقسیم میشود. نوک هر رشته انتهای پیش سیناپسی نام دارد.
ارتباط بین نواحی انتهایی سلول عصبی و عضله ، اتصال عصبی-عضلانی یا سیناپس نام دارد.
پیام الکتریکی از مغز به
سمت اعصاب مهاجرت میکند و ترشح استیل کولین را از نواحی انتهایی پیش سیناپسی تحریک
میکند. این ماده شیمیایی از طریق گیرنده های حسی خاصی در بافت عضلانی جذب میشود.
اگر گیرنده هایی که با استیل کولین تحریک میشوند کافی باشند ، عضلات شما منقبض میشوند.
علائم بیماری های عصبی-عضلانی
علائم بیماری های عصبی-عضلانی
بر اساس نوع بیماری متنوع میباشند و ممکن است ملایم ، متوسط یا مهلک باشند. برخی
از این علائم شامل موارد زیر میباشند :
ضعف عضلانی
تحلیل عضلانی
گرفتگی عضلانی
سختی عضلانی که متعاقبا
منجر به بدشکلی های مفصلی یا اسکلتی می شود
درد عضلانی
مشکلات تنفسی
مشکلات بلع
علل ایجاد کننده بیماری های
عصبی-عضلانی
جهش های ژنتیکی
عفونت های ویروسی
بیماری های خودایمنی
بیماری های هورمونی
بیماری های متابولیک
سوء تغذیه
سموم و داروهای خاص
عوامل نامشخص
برخی از بیماری های عمده که سیستم عصبی-عضلانی را تحت تاثیر قرار می دهند به 4 گروه اصلی تقسیم میشوند که شامل موارد زیر می باشند:
بیماری های نورون های حرکتی
بنا به علل ژنتیکی یا دلایل نامشخص، نورون های حرکتی پایینی ( و گاهی نورون های حرکتی بالایی ) تدریجاً از بین رفته و می میرند. برخی از انواع مختلف بیماری های نورون حرکتی ژنتیکی ( ارثی ) شامل آتروفی عضلانی نخاعی پیشرونده نوزادی (SMA1) ، آتروفی عضلانی نخاعی متوسط (SMA2) ، آتروفی عضلانی نخاعی جوانی (SMA3) و آتروفی عضلانی نخاعی بزرگسالی می باشند. شایع ترین فرم بیماری نورون حرکتی ، اسکلروز جانبی آمیوتروپیک (ALS) می باشد.
بیماری های نوروپاتی ها
سیستم اعصاب محیطی تحت تاثیر قرار می گیرد. برخی از انواع بیماری های اعصاب محیطی شامل بیماری ژنتیکی شارکوت-ماری-توث، دیابت های هورمونی ( اگر به خوبی درمان نشوند ) و بیماری های خود ایمنی مثل نوروپاتی دمیلینه کننده التهابی مزمن (CIPD) می باشند.
اختلالات اتصالات عصبی-عضلانی
در این بیماری ها ، انتقال
سیگنال حرکت ( انقباض ) عضله مختل میشود و پل ارتباطی بین عصب و عضله مسدود میشود.
شایع ترین فرم این بیماری ها میاستنی گراویس ، یک بیماری خودایمنی که در آن سیستم
ایمنی آنتی بادی هایی را تولید میکند که به اتصالات عصبی-عضلانی میچسبند و از
انتقال پیام عصبی به عضله جلوگیری میکنند ، میباشد.
میوپاتی ها و دیستروفی های عضلانی
بسیاری از انواع مختلف دیستروفی
های عضلانی ( تحلیل عضلانی ) که از جهش های ژنتیکی مختلفی ایجاد میشوند از حفظ و
ترمیم بافت عضلانی ممانعت میکنند. برخی از انواع مختلف این بیماری ها شامل دیستروفی
عضلانی بکر ، دیستروفی عضلانی مادرزادی ، دیستروفی عضلانی دوشن و دیستروفی عضلانی
صورت-لگن-شانه میباشند. بیماری های دیگر عضلانی ( میوپاتی ها ) میتوانند به صورت یک
عارضه جانبی نادر داروها ( برای مثال داروهای کاهنده کلسترول مثل استاتین ها ) ، بیماری
های خودایمنی مثل پلی میوسیت یا روماتیسم پلی میالژی یا اختلالات هورمونی مثل هیپوتیروئیدیسم
ظاهر شوند.
تشخیص اختلالات نوروژنتیک
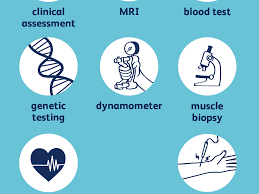
بررسی تاریخچه بالینی و معاینه
: بررسی تاریخچه بالینی از جمله سابقه بیماری در خانواده و معاینه بدن برای یافتن
علائم اختلال نوروژنتیک مثل علائم مادرزادی ویژه یا ویژگیهای فیزیکی یا نورولوژیکی
غیرطبیعی.
آزمایش خون: این آزمایش ها ممکن است آزمایش های معمول بیوشیمیایی ، شمارش سلول های خونی یا آزمایشهای متابولیک تخصصی تر باشند که به اختلال خاصی اشاره می کنند.
آزمایش های ادرار: آزمایش های ادرار نیز ممکن است برای بررسی مواد شیمیایی و پروتئین های ویژه در ادرار که نشاندهنده یک اختلال نوروژنتیک میباشند انجام شوند و جایگزین تست های تهاجمی تر شوند.
لومبار پانکچر: اگر آزمایش خون و ادرار نتیجه نداشت ، لومبار پانکچر که برداشت نمونه از مایع مغزی نخاعی میباشد ممکن است مفید باشد.
بیوپسی: ندرتا ، بیوپسی پوست یا ماهیچه ممکن است برای یک تشخیص ویژه مورد نیاز باشد.
تست ژنتیکی: بررسی DNA افراد میتواند تغییرات یا اختلالاتی را در ژن ها و کروموزوم ها نشان دهد که باعث یک اختلال نوروژنتیک میشوند. پیشرفت های ژنتیک مولکولی این امکان را میدهد تا به جای روش های تهاجمی تر مثل لومبار پانکچر و بیوپسی، آزمایش های خون برای بررسی متغیرهای ژنتیکی خاصی در خون که مرتبط با یک اختلال نوروژنتیک میباشند انجام شوند.
تصویر برداری رزونانس مغناطیسی (MRI :(MRI از میدان مغناطیسی و امواج رادیویی استفاده میکند تا تصویرهایی با جزئیات از بافت های داخلی بدن مثل مغز و اعصاب را ایجاد کند. MRI میتواند برای مشاهده علائم درون جمجمه ای اختلالات نوروژنتیک ویژه مورد استفاده قرار گیرد.
روش های درمانی
روش های درمانی اختلالات
نوروژنتیک به اندازه علائم این بیماری ها متنوع هستند. برخی از این روش ها عبارتند
از :
مشاوره ژنتیک: مشاوران ژنتیک نتایج آزمایش های ژنتیکی را به زبان ساده برای خانواده ها توضیح میدهند. این مشاوره به والدین کمک میکند نسبت به احتیاجات کودک بیمار خود و چگونگی تغییرات بیماری با گذر زمان آگاهی پیدا کنند.
داروها: پزشک فرزند شما ممکن است داروهایی را برای درمان علائمی چون تشنج تجویز کند. متخصصان نوروژنتیک و پزشک فرزند شما برای درمان علائم بیماری با هم همکاری میکنند و با تشخیص درست بیماری روش درمانی مربوط به بیماری را انتخاب میکنند.
جراحی های انکولوژیک: برخی اختلالات عصبی-پوستی باعث ایجاد تومور میشوند. جراحی در درمان برخی از این تومورها نقش ایفا میکند.
درمان فیزیکی و درمان حرفه ای: اگر فرزند شما عدم تعادل ، تون ماهیچه ای ضعیف یا انقباض را تجربه کند ، درمان فیزیکی و حرفه ای میتواند به حفظ و بهبود تعادل و انعطاف کمک کند و باعث بهبود برخی تاخیر های رشدی شود.
آسیب شناسی گفتار: یک آسیب شناس گفتار با فرزند شما کار خواهد کرد تا توانایی ارتباط کلامی را در وی ارتقا دهد.
شرایط انجام آزمایش
بهترین نوع نمونه خون تام
در لوله EDTA می باشد.
انجام مشاوره ژنتیک قبل از
آزمایش و تکمیل فرم های مربوطه الزامی است.
مدت زمان انجام آزمایش از 2
تا 5 ماه متغییر است.
برای انجام آزمایش نیازی به
ناشتا بودن وجود ندارد.
بعد انجام مرحله اولیه ممکن
است نیاز به جلسات مجدد مشاوره ژنتیک وجود داشته باشد.
نتیجه اولیه در یک بازه
زمانی بین 15 الی 30 روز بعد از نتیجه اولیه مورد تایید نهایی قرار خواهد گرفت (بدون
اخذ هزینه مازاد).
بسته به نتایج حاصله ممکن
است نیاز به نمونه گیری از سایر اعضای خانواده نیز وجود داشته باشد.
محدودیت آزمایش
در مواردی نتیجه به دست
آمده از آزمایش ممکن است با اطلاعات علمی موجود قابل تفسیر نباشد و نیاز به مراحل
تکمیلی بیشتری وجود داشته باشد.
هزینه زیاد این آزمایش از دیگر
محدودیت های آن می باشد.