تصور کنید برای یک بیماری ساده یا پیچیده به پزشکتان مراجعه کردهاید. پزشک نمونهای از خون یا موی شما را میگیرد و با تحلیل ترکیب ژنتیکی شما یک داروی کاملا اختصاصی برایتان تجویز میکند.
گرچه این مساله در حال حاضر به صورت عملی برای درمان بیشتر بیماریها امکان پذیر نیست، اما آینده علم دارو و درمان به سمت تولید داروهای اختصاصی برای هر فرد و براساس اطلاعات ژنی وی پیش میرود.

مطالعات دارویی و درمانی و اثرات متقابل دارو بر متابولیسم افراد سبب شده تا محققان به این نتیجه برسند که بهترین روش درمان تولید و تجویز داروهای اختصاصی براساس ویژگیهای ژنتیکی افراد است. این مساله میتواند اثربخشی دارو را افزایش دهد و از عوارض جانبی آن بکاهد.
در همین راستا مطالعات فارماکوژنومیکس به کمک دانشمندان میآیند. در فارماکوژنومیکس تفاوتهای ژنتیکی موروثی در مسیرهای متابولیسم داروهایی بررسی میشوند و به بررسی نقش تفاوتهای ژنتیکی در ارتباط با واکنش به داروها از طریق بررسی سیستماتیک ژنها، محصولات ژنی و تغییرات فردی در بیان و عملکرد ژن میپردازد.
در صورت عملی شدن این مساله، افرادی که بیماری آنها به طور مستقیم با ژنتیکشان مرتبط است سود بسیاری میبرند. به این ترتیب شانس درمان بیماریهای روانی مانند افسردگی، انواع سرطانها، بیماریهای مغزی مانند زوال مغز و نورودژنراتیوهمچون آلزایمر و پارکینسون، که با ژنتیک افراد رابطه مستقیمی دارند، افزایش قابل توجهی خواهد یافت.
تاریخ فارماکوژنومیکس به ۵۱۰ سال پیش از میلاد مسیح باز میگردد؛ زمانی که فیثاغورس متوجه شد که استفاده از باقلا سبب مرگ برخی افراد خواهد شد اما بر برخی دیگر بیاثر است. با این وجود مطالعات جدید در این زمینه از نیمه دوم قرن بیستم میلادی و به دنبال افزایش میزان دانش بشر در مورد علم ژنتیک آغاز شد.
فارماکوژنتیکس و فارماکوژنومیکس به موضوعاتی بحث برانگیز در زمینه اخلاق زیستی و پزشکی تبدیل شدهاند. فراگیر شدن این علوم که درمان بیماریهای رایج و نادر را شامل خواهد شد تاثیر زیادی بر جامعه خواهد گذاشت.
به دلیل نوپا بودن این علوم سوالات زیادی در رابطه با مسائل اخلاقی و راهحلهای احتمالی مقابله با مشکلات انسانی مطرح شده است. به عنوان مثال دسترسی به اطلاعات ژنتیکی افراد تا چه اندازه ممکن است در زندگی خصوصی آنها اهمیت داشته و حریم خصوصی آنها را به خطر بیاندازد. به علاوه مسائلی چون ایمنی دارو، نحوه دسترسی به آن و برقراری عدالت در درمان بیماران نیز از مسائلی است که باید مورد توجه قرار گیرد.
ﭘﺰﺷﻜﻲ ﺍﻧﻔﺮﺍﺩﻱ ﺑﻪ ﺭﻭﻳﻜﺮﺩ ﺟﺪﻳﺪﻱ ﺍﺯ ﻃﺐ ﺍﻃﻼﻕ ﻣﻲ ﺷﻮﺩ ﻛﻪ ﺩﺭ ﺁﻥ ﻣﺪﺍﺧﻼﺕ ﭘﺰﺷﻜﻲ ﺑﺮ ﺍﺳـﺎﺱ ﻭﻳﮋﮔـﻲ ﻫـﺎﻱ ﻓـﺮﺩﻱ ﺑﻴﻤﺎﺭﺍﻥ ﺑﻨﺎ ﻣﻲ ﺷﻮﺩ ﻛﻪ ﺷﺎﻣﻞ ﺍﻃﻼﻋﺎﺕ ﮊﻧﺘﻴﻜﻲ ﻭ ﻓﻨﻮﺗﻴﭙﻲ ﺁﻧﻬﺎﺳﺖ .ﺑﺎ ﭘﻴﺪﺍﻳﺶ ﻋﻠﻮﻣﻲ ﻧﻈﻴﺮ ﮊﻧﻮﻣﻴﻚ، ﭘﺮﻭﺗﻮﻣﻴﻚ، ﻟﻴﭙﻮﻣﻴﻚ ﻭ ﻏﻴﺮﻩ ﻛﻪ ﺑﺎﻋﺚ ﺷﻨﺎﺳﺎﻳﻲ ﺗﻔﺎﻭﺕ ﻫﺎﻱ ﻓﺮﺩﻱ ﺍﻓـﺮﺍﺩ ﻣـﻲ ﮔـﺮﺩﺩ، ﺍﻣﻜـﺎﻥ ﺗﻮﻟﻴـﺪ ﺩﺍﺭﻭﻫـﺎ ﻭ ﺑﻴﻮﻣﺎﺭﻛﺮﻫـﺎﻱ ﺗﺸﺨﻴﺼـﻲ ﻭ ﻏﺮﺑـﺎﻟﮕﺮﻱ ﺑﻴﻤﺎﺭﻳﻬﺎ ﻓﺮﺍﻫﻢ ﺧﻮﺍﻫﺪ ﺷﺪ ﺗﺎ ﭘﺰﺷﻜﺎﻥ ﺑﺮ ﺍﺳﺎﺱ ﻭﻳﮋﮔﻲ ﻫﺎﻱ ﮊﻧﺘﻴﻜﻲ ﻭ ﮊﻧﻮﻣﻲ ﻫﺮ ﻓﺮﺩ ﺑﺘﻮﺍﻧﻨﺪ ﻧﻮﻉ ﻭ ﻣﻘﺪﺍﺭ ﺩﺍﺭﻭ ﺭﺍ ﺑﺮﺍﻱ ﻫﺮ ﺑﻴﻤﺎﺭ ﺑﻪ ﺻﻮﺭﺕ ﺍﻧﻔﺮﺍﺩﻱ ﺗﻌﻴﻴﻦ ﻧﻤﺎﻳﻨﺪ. ﺑﺎ ﺍﺳﺘﻔﺎﺩﻩ ﺍﺯ ﺁﻧﺎﻟﻴﺰﻫﺎﻱ ﻣﻮﻟﻜﻮﻟﻲ ﻣﻲ ﺗﻮﺍﻥ ﻭﺍﺭﻳﺎﻧﺖ ﻫﺎﻱ ﮊﻧﺘﻴﻜﻲ ﻣﺨﺘﻠﻒ ﺭﺍ ﺷﻨﺎﺳـﺎﻳﻲ ﻛـﺮﺩ ﺗـﺎ ﺑﻪ ﻭﺍﺳﻄﻪ ﺁﻧﻬﺎ ﺍﻣﻜﺎﻥ ﻏﺮﺑﺎﻟﮕﺮﻱ ﺍﻓﺮﺍﺩ ﺩﺍﺭﺍﻱ ﺭﻳﺴﻚ ﺍﺑﺘﻼ ﺑﻪ ﺑﻴﻤﺎﺭﻱ ﺧـﺎﺹ ﻓـﺮﺍﻫﻢ ﮔـﺮﺩﺩ ﻭ ﺩﺍﺭﻭﻫـﺎﻳﻲ ﻛـﻪ ﻣﺘﻨﺎﺳـﺐ ﺑـﺎ ﺯﻣﻴﻨـﻪ ﮊﻧﺘﻴﻚ ﺑﻴﻤﺎﺭ ﺍﺳﺖ ﺭﺍ ﻃﺮﺍﺣﻲ ﻭ ﺗﺠﻮﻳﺰ ﻧﻤﻮﺩ ﻭ ﺍﺯ ﺍﻳﻦ ﻃﺮﻳﻖ ﻣﺘﻨﺎﺳﺐ ﺗﺮﻳﻦ ﺭﻭﺵ ﺗﺸﺨﻴﺺ ﻭ ﺩﺭﻣﺎﻥ ﺭﺍ ﺑﺮﺍﻱ ﺑﻴﻤﺎﺭ ﺍﻧﺠﺎﻡ ﺩﺍﺩ .ﺩﺭ ﻭﺍﻗﻊ ﭘﺰﺷﻜﻲ ﺍﻧﻔﺮﺍﺩﻱ ﭘﻠﻲ ﻣﻴﺎﻥ ﭘﺰﺷﻜﻲ ﻓﻌﻠﻲ ﺑﺎ ﭘﺰﺷﻜﻲ ﺁﻳﻨﺪﻩ ﺧﻮﺍﻫﺪ ﺑـﻮﺩ.
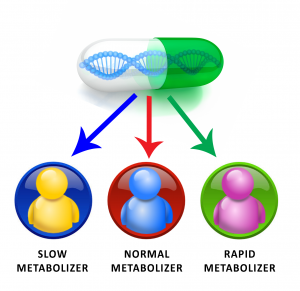
ﭘﻴﺸﺮﻓﺖ ﻫﺎﻱ ﺭﻭﺯ ﺍﻓﺰﻭﻥ ﻋﻠﻢ ﭘﺰﺷﻜﻲ ﺳﺒﺐ ﺷـﺪ ﻛـﻪ ﺗﺸﺨﻴﺺ ﻭ ﺩﺭﻣﺎﻥ ﺑﻴﻤﺎﺭﻱ ﻫﺎ ﻛﺎﺭﺁﻣﺪﺗﺮ ﺷﻮﺩ. ﻳﻜﻲ ﺍﺯ ﺍﻳـﻦ ﭘﻴﺸﺮﻓﺖ ﻫﺎ ﭘﺮﻭﮊﻩ ﮊﻧﻮﻡ ﺍﻧﺴﺎﻥ ﺍﺳﺖ ﻛﻪ ﺑﺎ ﺗﻜﻤﻴﻞ ﺷﺪﻥ ﺁﻥ ﺩﺭﻳﭽﻪ ﺗﺎﺯﻩ ﺍﻱ ﺍﺯ ﺩﻳﺪﮔﺎﻩ ﻋﻠـﻢ ﮊﻧﺘﻴـﻚ به ﺳـﻤﺖ ﺩﻧﻴـﺎﻱ ﭘﺰﺷﻜﻲ ﺑﺎﺯ ﺷﺪ. ﺗﻜﻤﻴﻞ ﺍﻳـﻦ ﭘـﺮﻭﮊﻩ ﺳـﺮﺁﻏﺎﺯ ﻳـﻚ ﺩﻭﺭﻩ ﺟﺪﻳﺪﻱ ﺑﻪ ﻧﺎﻡ ﭘﺴـﺎ – ﮊﻧـﻮﻣﻲ ﺑـﻮﺩ ﻛـﻪ ﺳـﺒﺐ ﺷـﺪ. ﻣﻔـﺎﻫﻴﻢ ﻋﻠﻤـــﻲ ﺟﺪﻳـــﺪ ﻫـــﻢ ﭼـــﻮﻥ ﮊﻧﻮﻣﻴـــکس، ﭘﺮﻭﺗﺌﻮﻣﻴـــﻚ، ﻓﺎﺭﻣﺎﻛﻮﮊﻧﻮﻣﻴکس وارد دنیای پزشکی شود.
توالی ﻳـــﺎﺑﻲ ﮊﻧـــﻮﻡ ﺍﻧﺴـــﺎﻥ ﺑـــﻪ ﻫﻤـــﺮﺍﻩ ﭘﻴﺸـــﺮﻓﺖ ﻭ ﺗﻮﺳـــﻌﺔ ﺗﻜﻨﻮﻟﻮﮊﻱ ﻫﺎﻱ ﭘﺮ ﺑﺎﺯﺩﻩ ﻛﻪ عمدتا ﺑـﻪ ﻭﺍﮊﻩ Omics ﺧـﺘﻢ ﻣـﻲ ﺷـﻮﺩ، ﺩﺍﻧــﺶ ﺑﺸـﺮﻱ ﺭﺍ ﺩﺭ ﻣــﻮﺭﺩ ﺑﻴﻤـﺎﺭﻱ ﻭ ﺳــﻼﻣﺘﻲ ﺑﻬﺒﻮﺩ ﺑﺨﺸﻴﺪﻩ ﻭ ﭘﺎﻳﻪ ﺍﻱ ﺭﺍ ﺑﺮﺍﻱ ﭘﺰﺷـﻜﻲ ﺍﻧﻔـﺮﺍﺩﻱ ﻓـﺮﺍﻫﻢ ﻛﺮﺩه است. ﺗﺮﻛﻴﺐ ﺍﻃﻼﻋﺎﺕ ﺣﺎﺻﻞ ﺍﺯ ﺭﺷﺘﻪ ﻫـﺎیی که ﻣﻨﺘﻬـﻲ ﺑـﻪ Omics می ﺷﻮﺩ ﻛـﻪ ﺍﻟﮕﻮﻫـﺎﻱ ﺳـﺎﺧﺘﺎﺭﻱ ﻋﻤـﻮﻣﻲ ﺑﻪ ﺳﻤﺖ ﺍﺧﺘﺼﺎﺻﻲ ﺷﺪﻥ ﭘﻴﺶ ﺭﻭﺩ. ﺍﻳﻦ ﻧﮕﺮﺵ ﻫﻤﺎﻥ ﺗﻌﺮﻳـﻒ ﭘﺰﺷـﻜﻲ ﺍﻧﻔـﺮﺍﺩﻱ ﺍﺳـﺖ ﻳﻌﻨـﻲ ﺍﺳﺘﻔﺎﺩﻩ ﺍﺯ ﺧﺼﻮﺻﻴﺎﺕ ﮊﻧﺘﻴﻜﻲ ﻳـﺎ ﻣﻮﻟﻜـﻮﻟﻲ ﺍﻓـﺮﺍﺩ ﺑـﺮﺍﻱ ﺗﻌﻴﻴﻦ ﻧﻮﻉ ﺩﺭﻣﺎﻥ ﺁﻥ ها. ﺍﻣﺎ ﻳﻜﻲ ﺍﺯ ﻣﻬـﻢ ﺗـﺮ ﻳﻦ ﻣﺸـﻜﻼﺗﻲ ﻛــﻪ ﺩﺭ ﺯﻣﻴﻨــﺔ ﭘﺰﺷــﻜﻲ ﺍﻧﻔــﺮﺍﺩﻱ ﻭﺟــﻮﺩ ﺩﺍﺭﺩ، ﺗﺒــﺪﻳﻞ ﺗﺤﻘﻴﻘﺎﺕ ﻭ ﻛﺸﻒﻫﺎﻱ ﻋﻠﻤﻲ ﺑﻪ ﺳﻤﺖ ﺑﺎﺯﺩﻫﻲ ﻭ ﻛﺴـﺐ ﺑﻬﺘﺮﻳﻦ ﻧﺘﻴﺠﺔ ﺩﺭﻣﺎﻧﻲ ﺍﺳﺖ ﻛﻪ ﺑﺎ ﻛﻤـﻚ ﺑﻴﻮﺍﻧﻔﻮﺭﻣﺎﺗﻴـﻚ ﻣــﻲ ﺗــﻮﺍﻥ ﻓﺎﺻــﻠﻪ ﺑــﻴﻦ ﺗﺤﻘﻴﻘــﺎﺕ ﺳﻴﺴــﺘﻢ ﺑﻴﻮﻟــﻮﮊﻱ ﻭ ﺁﺯﻣﺎﻳﺶهای بالینی را پر کرد.
دیربازی است که بحث طراحی داروهای منحصر به فرد برای هر بیمار مطرح است اما به نظر می رسد این موضوع شتاب جدی در عرصه دارویی پیدا کرده و درصورتیکه برنامه ریزی برای مواجه با این حوزه نوآورانه در سیاست های وزارت بهداشت و سازمان دارو غذا منظور نگردد دیر یا زود با مشکلاتی در مدیریت بازار داروهایی که بر مبنای این ویژگی به بازار دارویی وارد می شوند مواجه می گردیم ایجاد زیرساخت لازم و ظرفیت آزمایشگاهی برای ارزیابی ژنتیکی بیماران و هدایت آنها به سمت مصرف و یا عدم مصرف یک دارو از پیش نیازهای تسلط بر این بازار خواهد بود.
کشف دارو و توسعه دارو
بیوانفورماتیک و نقش فارماکوژنومیکس در فرآیند کشف دارو و فرآیند توسعه بیوانفورماتیک
بیوانفورماتیک و نقش فارماکوژنومیکس در فرآیند کشف و توسعه دارو
بیوانفورماتیک و نقش فارماکوژنومیکس در فرآیند کشف دارو و فرآیند توسعه
فارماکوژنومیکس و بیوانفورماتیک به اثرات پلی مورفیسم ژنتیکی و انواع ژنومی در واکنش دارو اشاره میکند، دانش آن میتواند به انتخاب فرآیند بهینه دارو، دوز و درمان کمک کند و از واکنش های منفی دارو اجتناب کند. دانش زیستی ژنتیکی و بیوانفورماتیک مرتبط با بیماری، شرکتهای داروسازی را به طراحی فارماکوژنومیکس و دوزهای فردی و دوزهای فردی هدایت میکند. این کار با مشاهده الگوهای ژنتیکی و پلی مورفیسم این عناصر ژنتیکی انجام میشود که تعامل با دارو یا محصولات فرعی آن را نشان میدهد و به طریقی با فارماکوژنومیکس دارو مرتبط میشود. عوارض جانبی داروها به عنوان یکی از دلایل اصلی مرگ در بین بیماران بستری گزارش شدهاست و اکثریت ۱۷ تا ۲۹ میلیارد دلار هزینههای سالانه اشتباه ات پزشکی را تشکیل می دهد. واکنشهای جانبی دارویی همچنین به عنوان عامل از دست دادن اعتماد در سیستم بهداشت و درمان و رضایت رو به کاهش هم بیماران و هم متخصصان بهداشتی گزارش شده است.

دارو و پزشکی شخصی
رویکرد فارماکوژنومیکس ، شرکتهای داروسازی را قادر میسازد تا داروهایی را طراحی کنند که الزامات زیر گروههای ژنتیکی خاص جمعیت عمومی را برآورده سازند. هدف اصلی فارماکوژنومیکس و بیوانفورماتیک شناسایی بیمارانی است که اثر بخشی دارو را می توان پیش بینی کرد و به منظور کاهش ریسک اثرات مضر دارو از آن افراد استفاده کرد .وعده ی تجویز داروها براساس پروفایل ژنتیکی بیماران به عنوان “داروی شخصی” شناخته میشود. این کار باعث کاهش گمانه زنیهای مصرف داروهای تجویزی ساتفاده میشود و در نتیجه اعتماد به پزشک و هم بیمار را افزایش میدهد و روشهای غالب برای کشف دارو و توسعه ، تشخیص، درمان و استراتژیهای پیشگیری از بیماریها را اصلاح میکند. همچنین برای جامعه نیز مفید است چون مصرف داروهای گران قیمت در بیمارانی که اختلالات آن توسط این داروها درمان نمیشوند، اجتناب میشود. بیوانفورماتیک همچنین منابع اطلاعاتی مربوط به فارماکوژنومیکس را فراهم میکند که حاوی اطلاعاتی در مورد انواع مختلف پلی مورفیسم بوده و واکنش متغیر وابسته به دارو را بررسی می کند گزارش شده است که دارو های مختلف ، واکنشهای منفی دارو را نشان میدهند که اغلب منجر به بستری شدن و در برخی موارد موجب تلفات میشود. تحقیقات درباره چنین واکنشی به دارو منجر به خروج دارو از بازار شده است. این مساله بلافاصله توسط مجموعهای از پروندههای حقوقی برای سو درمان دارویی پی گیری میشود.رویکرد فارماکوژنومیکس برای استراتژی توسعه دارو فرصتی برای معکوس کردن این روند است. وعده داده شده است که ممکن است منجر به “توسعه دقیق مواد دارویی” شود. داروهای با دقت به داروهایی اشاره میکنند که با ترکیب ژنتیکی افراد متناسب هستند. این داروها را می توان در آزمایشهای کلینیکی کوتاه و ساده ارزیابی کرد و اثرات نامطلوبی بر روی آنها نشان خواهد داد را ارزیابی کرد.تایید و آزمایش ژنتیکی قبل از تجویز دارو و آنالیز بیوانفورماتیکی به شدت شانس نسخه غلط دارو را کاهش میدهد.
استفاده از دارو های بی مصرف
در فرآیند کشف دارو و توسعه دارو ، شرکتهای داروسازی بیشتر بر روی داروهای اصلی متمرکز میمانند که به بیش از ۲۰ میلیون نفر توصیه میشود ، این داروها به عنوان داروهای Blockbuster شناخته میشوند. نتیجه این کار فقدان مواد دارویی است که ممکن است برای درمان بیماریهایی که تنها بر تعداد کمی از مردم تاثیر می گذارند، توسعه داده شود.این داروها – یا داروهای بالقوه به عنوان دارو های رها شده یا یتیم شناخته میشوند. یک استراتژی فارماکولوژی برای توسعه دارو ممکن است این داروهای رها شده را احیا کند اگر بتوان ثابت کرد که ذینفعان بالقوه برای این داروها وجود دارند . از نقطه نظر تجاری، اگر شرکت داروسازی بتواند از چیزی مانند وضعیت دارو های رها شده در محصول خود بهره مند شود، این کار به تشویق طبقه بندی جمعیت ها براساس فارماکوژنتیکس با بیوانفورماتیک کمک خواهد کرد، زیرا کاهش اندازه یک جمعیت میتواند با اولویت دارویی جبران شود. این تنها راهی است که شرکتهای داروسازی میتوانند ترغیب شوند تا این تعصب blockbuster را رها کنند. در سال های اخیر، مقامات مختلف منابع و طراحی دارو های با پتانسیل فارماکوژنومیکس را تشخیص دادهاند و چنین روشهایی را برای کشف دارو و فرآیند تحویل تشویق کردهاند.همانطور که فن آوریهای فارماکوژنومیکس همچنان پدیدار و رشد می یابند، نهاد های نظارتی بین المللی دستورالعملهای فارماکوژنومیکس و مقررات را توسعه میدهند. با این حال، افزایش توجه و پتانسیل مستند و تعهد استراتژیهای توسعه دارو مبتنی بر فارماکوژنومیکس ، مقاومت مداومی برابر این رویکرد در بخش شرکتهای داروسازی وجود داشته است. دلیل این مقاومت، این درک است که یک استراتژی فارماکوژنومیکس و تحلیل بیوانفورماتیک منجر به از بین رفتن قابل توجه ضرر حاصل از تجزیه و تحلیل بازار دارو میشود. علاوه بر این، چنین ادراکی از بیرون نشاهده میشود و به عنوان “اسطوره” توسط برخی از مصرف کننده گان در نظر گرفته میشود، آنها گزارش دادند که استراتژی فارماکوژنومیکس پتانسیل افزایش اندازه بازار دارو را در پیش دارد.
موانع پیشرفت در زمینه توسعه و طراحی دارو
فارماکوژنومیکس براساس تغییرات ژنومی به طور خاص در کد گذاری یا نزدیک به مناطق کدینگ است. پیش بینی تغییرات ژنی با ابزار های بیوانفورماتیک که بر واکنش دارو اثر میگذارند بسیار دشوار است. چند شکلی های تک نوکلیوتیدی نقش مهمی در پاسخ به داروی متغیر ایفا میکند. SNPs ها هر ۱۰۰ – ۳۰۰ باز در امتداد ژنوم انسانی با سه میلیارد باز اتفاق میافتد؛ بنابراین، میلیون ها از این ها باید شناسایی و توسط نرم افزار های بیوانفورماتیک آنالیز شوند تا دخالت آنها در واکنش به دارو تعیین شود. آگاهی محدود و دانش نسبت به رابطه بین انواع ژن و واکنش متغیر دارو نیز به عنوان عاملی محدود کننده برای طراحی دارو و فرآیند تحویل دارو عمل میکند . از آنجا که بسیاری از ژنها به احتمال زیاد بر پاسخها اثر می گذارند، به دست آوردن یک تصویر بزرگ از اثر تغییرات ژن به شدت وقت گیر و پیچیده است، و برای این منظور، ما به پروفایل ژنتیکی هر فرد نیاز داریم که در آیندهای نزدیک امکان پذیر نیست و حتی با نرم افزار های بیوانفورماتیکی در حال حاظر بسیاز زمان بر می باشد . پزشکان همچنین باید یک مرحله تشخیصی اضافی را اجرا کنند تا مشخص شود کدام دارو برای هر بیمار مناسب است. برای تفسیر دقیق تشخیصی و توصیه بهترین دوره درمان برای هر بیمار، تمام پزشکان تجویز بدون توجه به تخصص به درکی بهتر از ژنتیک نیاز خواهند داشت. برخی ملاحظات اخلاقی نیز باید پیش از اجرای بالینی روتین فارماکوژنومیکس انجام شوند. در عین حال، اقتصاد آزمایش فارماکوژنومیکس از دیدگاه بیماران، پزشکان، شرکتهای بیمه، دولتها، و شرکتهای داروسازی نقش مهمی در تعیین استفاده از آینده آن ایفا خواهد کرد.
نتیجهگیری
طراحی دارو یک فرآیند بسیار پیچیده، پرهزینه و زمانبر است. هم بیوانفورماتیک و هم فارماکوژنومیکس پشتیبانی زیادی را برای غلبه بر هزینه و شرایط زمان فراهم میکنند. بیوانفورماتیک توصیف کننده طیف گستردهای از پایگاه های داده و نرم افزارهای مرتبط با دارو است که میتواند برای اهداف مختلف، مربوط به طراحی و فرآیند توسعه دارو مورد استفاده قرار گیرد. همچنین، فارماکوژنومیکس اطلاعات سطح ژنوم را در مورد واکنش دارو متغیر فراهم می کند، که برای شرکت های داروسازی بسیار مهم است که داروهای جدید طراحی کنند اگرچه، بیوانفورماتیک و فارماکوژنومیکس هنوز در مرحله اولیه خود هستند و در حال حاضر با موانعی مواجه هستند که به اندازه کافی پتانسیل لازم برای کمک به روند توسعه دارو در آینده نزدیک را نشان میدهند.